|
近日,Intertek瑞典公告机构IMNB(NB 2862)依据欧盟医疗器械法规(MDR,EU 2017/745),为安徽天康医疗科技股份有限公司(天康医疗,股票代码:835942)颁发了MDR IIa类证书,产品包含一次性使用注射器,自毁式注射器,注射针,输液器等,充分巩固其海外市场准入。
Intertek曾助力天康医疗成功取得MDSAP认证。时隔一年,顺利为其颁发了MDR证书,不仅再次展现了天康医疗的专业领先及全球视野,更是Intertek与天康医疗携手合作的共赢。
Intertek在MDR认证领域以其经验丰富、能力专业、精准服务获得了客户的高度认可与赞誉。本次MDR的颁发,提升了天康医疗在国际医疗行业的地位,为天康集团进一步扩宽国际市场提供了更强大的基础和保障,同时再一次展示了Intertek集团为国产医疗器械的发展持续助力护航的愿景及能力。
天康医疗科技股份有限公司

天康医疗科技股份有限公司为安徽天康集团1999年创立的下属公司,专业从事一次性使用无菌回缩型自毁式注射器、自毁式注射器、输液器、输血器、体外循坏血液管路产品、喂食器、静脉留置针、滴定管式输液器等产品研发和生产,其拥有100多个品种的医疗耗材产品。
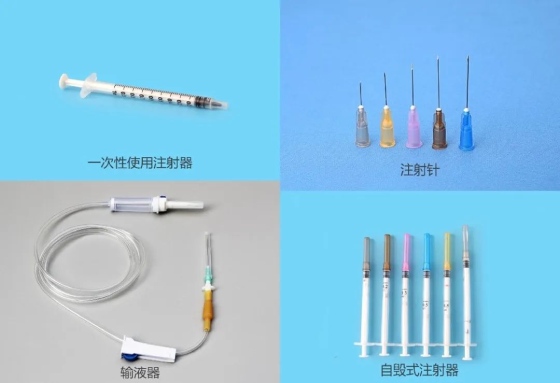
其中一次性使用无菌自毁式注射器出口国内第一,是联合国机构唯一一家中国供应商入围产品。公司顺应国际国内经济形势,以高新技术高附加值产品的研发和销售为战略发展方向。
Intertek天祥集团MDSAP医疗器械单一审核服务
Intertek的MDSAP医疗器械单一审核服务,被5大国家监管机构广泛认可,被监管机构评价为行业的标杆,同时又以高效、有序的发证流程被众多医疗器械企业所称赞。Intertek 已经帮助众多国内外医疗器械企业顺利获得了 MDSAP 证书,为企业加速海外上市流程,降低法规准入的费用,赢得快速占领市场的先机提供有力的支持。
医疗器械单一审核程序(MDSAP)是国际医疗器械监管者论坛(IMDRF)针对医疗器械制造商的质量管理体系开展审核工作制定的一组要求标准。审核涵盖ISO13485:2016和不同国家法规机构的要求。医疗器械单一审核方案(MDSAP)允许医疗器械制造商只接受一次质量管理体系审核,即可满足五个国家的标准和法规要求,目前加入MDSAP试点项目的法规机构包括:澳大利亚治疗品管理局(TGA)、巴西卫生局(ANVISA)、加拿大卫生局(Health Canada)、日本厚生劳动省(MHLW)和日本药品医疗器械管理局(PMDA)、美国食品药品监督管理局(FDA)。

Intertek作为权威的全球质量和安全服务机构,下属公告机构(IMNB),获得了MDR的授权,公告号为2862,机构的授权范围几乎覆盖了有源,无源各个风险等级的所有医疗器械,可以持续地为全球众多医疗器械企业提供欧盟市场准入服务。
Intertek为医疗器械行业提供专业创新的解决方案,根据各类安全、质量和性能法规和标准帮助客户对其医疗及防疫物资的产品和体系货物进行评估,服务包括测试、认证、审核、安全、检验、质量保证、评估、分析、咨询、培训、外包、风险管理和供应链安全验证等。
如您有任何需求,请发送邮件至:
China.medical@intertek.com
|